Celltrion Healthcare Holdings feat. 셀트리온 합병
셀트리온 그룹이 합병을 진행한다고 합니다.
셀트리온 그룹이 공시를 통해 셀트리온 3사(셀트리온, 셀트리온 제약, 셀트리온 헬스케어) 합병 계획을 발표하였는데요.
먼저 3사 합병을 위한 준비 단계로 셀트리온헬스케어의 최대주주인 서정진 회장이 보유한 셀트리온헬스케어 주식을 현물출자해 셀트리온헬스케어홀딩스(헬스케어홀딩스)를 설립하였습니다.

셀트리온 측에서 공시한 바에 따르면, 소유와 경영의 분리 및 지배구조 강화를 위한 작업이라고 설명하였는데요.
적격합병 요건이 갖춰진 후 즉시 셀트리온홀딩스와 셀트리온헬스케어홀딩스의 합병을 추진할 것이며,
2021년 말까지 셀트리온그룹의 지주사 체제를 갖추겠다는 계획을 갖고 있다고 하였습니다.
셀트리온 그룹의 합병이 어떻게 도움될 지 알아볼까요?
가장 먼저, 이번 헬스케어홀딩스 설립을 통해 지주회사 체제를 확립함으로써 소유와 경영을 분리해 한단계 발전을 위한 전문 경영인체제를 마련하게 되었습니다.
또한, 단일 회사에서 개발과 생산 및 유통, 판매까지 동시에 이뤄지기 때문에 거래구조 개선을 통한 비용 절감 및 사업의 투명성이 제고되는 효과를 기대해볼 수 있겠습니다.
마지막으로 의약품의 연구/개발부터 마케팅 및 직접판매 유통망까지 갖춘 대규모 제약회사가 탄생하게 돼 글로벌 시장에서 더 큰 영향력과 경쟁력을 갖게 될 것으로 전망해볼 수 있습니다.
추가로, 그룹 내 바이오의약품과 케미컬의약품 등 주요 제품들로 경쟁력 있는 포트폴리오를 구성해 국내외 시장에 선보이게 되면 매출 규모 확대 및 판매 채널 단일화에 따른 효율성 측면의 양적, 질적 성장에 기여할 것으로 보여집니다.
그렇다면, 현재 각 사의 현황을 한번 볼까요?
셀트리온
동사는 생명공학기술 및 동물세포대량배양기술을 기반으로 항암제 등 각종 단백질 치료제(therapeutic proteins)를 개발, 생산하는 것을 목적사업으로 하고 있음.
아시아 최대인 140,000L 규모의 동물세포배양 단백질의약품 생산설비를 보유하고 있으며 향후 개발 일정과 수요 등을 고려하여 3공장 신설 예정.
세계 최초 개발한 자가면역질환 치료용 바이오시밀러 ‘램시마’는 2016년 미국 FDA로 부터 판매 승인 받음.
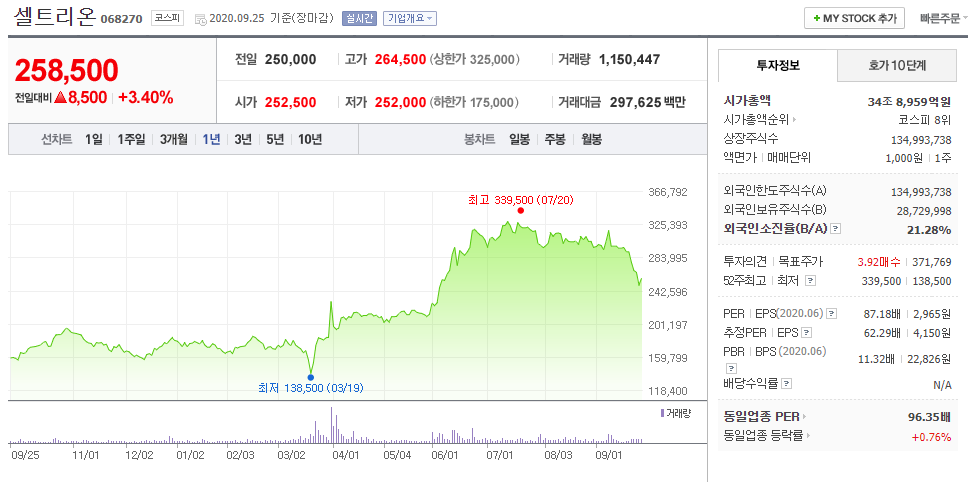
셀트리온헬스케어
1999년 12월 설립된 동사는 주요 계열사인 셀트리온과 공동 개발 중인 바이오의약품(바이오시밀러, 바이오베터, 바이오 신약)들의 글로벌 마케팅 및 판매를 독점적으로 담당하고 있음.
동사가 주력하고 있는 바이오시밀러 제품은 인플릭시맙(램시마), 리툭시맙(트룩시마), 트라스투주맙(허주마) 등임.
글로벌 제약사인 화이자, Teva 등을 포함하여 110여개 국가에서 30개 파트너와 판매 및 유통 파트너십을 구축하고 있음.

셀트리온제약
동사는 KGMP, cGMP, EU-GMP 적격업체로, 충북 진천과 오창에 생산 및 품질 관리시설을 갖추고 40여 전문의약품을 생산하고 있으며, 다양한 제품파이프라인을 보유중임.
주력제품 고덱스는 기존 간질환치료제인 헤파디프와 DDB제제의 배합 비율을 찾아 2상,3상 임상 실시로 5년 노력 끝에 개발함.
바이오시밀러 국내 독점판매권과 유통권을 확보함으로써 기존 케미컬 의약품과의 시너지 확대를 통한 시장지배력 강화를 도모하고 있음.

향후, 셀트리온 그룹이 세계 제약바이오 시장을 선도하는 종합생명공학기업으로 발돋움할 수 있을지 지켜 봐야겠습니다.
For foreigners,
Celltrion Group is said to be carrying out a merger.
Celltrion Group announced plans to merge with the three Celltrion companies (Celltrion, Celltrion Pharmaceutical, and Celltrion Healthcare) through a public announcement.
First, as a preparatory stage for the merger of the three companies, Celltrion Healthcare Holdings (Healthcare Holdings) was established by investing in-kind Celltrion Healthcare stock held by Chairman Jeong-jin Seo, Celltrion Healthcare's largest shareholder.
According to the disclosure of Celltrion, it was explained that it was a work to separate ownership and management and strengthen the governance structure.
Immediately after the requirements for a qualified merger are met, we will promote the merger of Celltrion Holdings and Celltrion Healthcare Holdings.
He said he has plans to establish a holding company system for Celltrion Group by the end of 2021.
Let's see how the merger of Celltrion Group will help?
First of all, by establishing a holding company system through the establishment of Healthcare Holdings, we have established a professional management system for further development by separating ownership and management.
In addition, since development, production, distribution, and sales are carried out at the same time in a single company, cost reduction and business transparency can be expected through improved transaction structure.
Lastly, it is expected that a large-scale pharmaceutical company with a distribution network from research/development to marketing and direct sales of drugs will be created, which will have greater influence and competitiveness in the global market.
In addition, if a competitive portfolio of major products such as biopharmaceuticals and chemicals within the group is formed and presented to the domestic and overseas markets, it is expected to contribute to the quantitative and qualitative growth of efficiency in terms of sales volume and unified sales channels.
If so, shall we take a look at the current status of each company?
Celltrion
The company aims to develop and produce various therapeutic proteins such as anticancer drugs based on biotechnology and animal cell mass culture technology.
It has the largest production facility of 140,000L of animal cell cultured protein drugs, which is the largest in Asia, and plans to establish 3 factories in consideration of future development schedule and demand.
The world's first biosimilar for the treatment of autoimmune diseases, “Remsima,” was approved for sale by the US FDA in 2016.
Celltrion Pharmaceutical
As a KGMP, cGMP, and EU-GMP qualified company, the company has production and quality control facilities in Jincheon and Ochang, North Chungcheong Province, produces more than 40 specialized pharmaceuticals, and has various product pipelines.
The flagship product Godex was developed after five years of effort by conducting phase 2 and 3 clinical trials to find the ratio of the existing liver disease treatment drug Hepadif and DDB.
By securing the domestic monopoly and distribution rights of biosimilars, we are trying to strengthen market dominance by expanding synergy with existing chemical drugs.
Celltrion Pharmaceutical
As a KGMP, cGMP, and EU-GMP qualified company, the company has production and quality control facilities in Jincheon and Ochang, North Chungcheong Province, produces more than 40 specialized pharmaceuticals, and has various product pipelines.
The flagship product Godex was developed after five years of effort by conducting phase 2 and 3 clinical trials to find the ratio of the existing liver disease treatment drug Hepadif and DDB.
By securing the domestic monopoly and distribution rights of biosimilars, we are trying to strengthen market dominance by expanding synergy with existing chemical drugs.
In the future, it remains to be seen whether Celltrion Group can become a comprehensive biotechnology company leading the global pharmaceutical bio market.